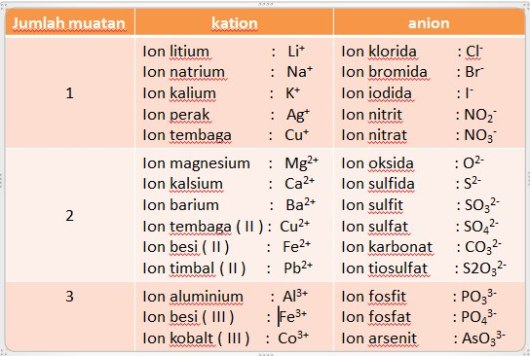
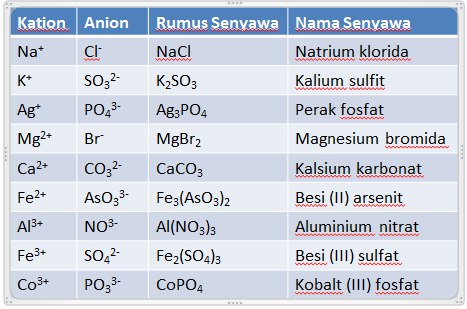
PETA MATERI
- Percakapan transaksional/ interpersonal:
- Teks fungsional pendek
Monolog / esei
- linguistic features
- vocabulary
KELAS X
SEMESTER I
Percakapan TeksFungsional P Monolog
- Berkenalan iklan
- berpisah pengumuman RECOUNT
- instruksi undangan NARRATIVE
- Ajakan PROCEDURE
- Tawaran
- Undangan
- Janji
- Rasabahagia
- Perhatian
- Simpati
MODUL
 RECOUNT, NARRATIVE, AND
PROCEDURE
RECOUNT, NARRATIVE, AND
PROCEDURE
§
Standar Kompetensi
: 5. Memahami makna teks tulis fungsional pendek
esei sederhana berbentuk recount,
narrative, dan procedure dalam
konteks kehidupan sehari-sehari .
§
Kompetensi Dasar : 5.2
Merespon makna dan langkah retorika teks
tulis esei secara akurat, lancar, dan berterima kasih dalam berbagai konteks
kehidupan sehari-hari dan untuk mengakses ilmu pengetahuan dalam teks: recount, narrative, dan procedure.
§
Alokasi
Waktu : 14 x 45 menit.
§
Materi
Pembelajaran: - Text tulis berbentuk Recount
-
Text tulis berbentuk Narrative
-
Text tulis berbentuk Procedure
1.
 RECOUNT
RECOUNT
Social function: to retell events for the
purpose of informing or entertaining
Generic structure
·
Orientation
: provides the setting and introduces
participants
(when, and where)
·
Events :
tell what happened in a chronological
order
·
Re-orientation : optional-closure of
events
Recount texts tell a series of events and evaluate their significance
in some way.
Language Features : - The use simple
past tenses
S + V2 ( we went for a trip to the
zoo )
Activity 1. Answer these following questions.
1. Do you have any interesting experience to tell?
2.
Can you recall it?
3. Will you tell your experience to your friend?
Activity 2.Read
and study
the text structure of the recount text.
 My Day
My Day
I had a terrible day yesterday. First, I woke
up an hour late because my alarm clock didn't go off. Then,
I was in such a hurry that I burned my hand when I was making breakfast. After breakfast,
I got dressed so quickly that I forgot to wear socks. Next, I ran out of the
house trying to get the 9:30 bus, but of course I missed it. I wanted to take a
taxi, but I didn't have enough money.
Finally,
I walked the three miles to my school only to discover that it was Sunday! I
hope I never have a day as the one I had yesterday.
Taken from Ready
to Write, 2003
Activity 3. Answer
the following questions based on the text activity 2.
1.
What
happened to the writer yesterday?
2.
Why did he
wake up an hour late?
3.
What did he
do after having breakfast?
4.
How far
did the writer walk?
5.
What does
the writer hope?
Activity 4. Say it Right and find their synonym.
1. wanted /wɒntɪd/
2. ran out /rʌn aʊt/
3. walked /wɔ:kd/
4. forgot /fə'gɒt/
5. missed /mɪsd/
6. burned /bɜ:nd/
7. woke up /wɒk ʌp/
8. hurry /hʌrɪ/
9. terrible /'terəbl/
10. quickly /kwiklɪ/
Grammar Spot
Simple Past Tense
(+) S + V2
(-)
S + did not + V1
(?) Did + S + V1
To talk about
past events and conditions, you use VERB-2 forms. Here are some examples taken
from the text.
(+) I joined
the Traditional Dance Competition in Jakarta
last year.
(-) I did
not feel nervous anymore.
The adverbs
that are usually used in the ‘simple past tense’ sentences are:
Yesterday,
last week, a week ago, …ago, last…,etc
Activity 5. Fill in the blanks with correct verb forms.
Look at the example.
am win take have join are
The Football Competition
When
I 1) was in the Junior High School, I joined two clubs.
They 2) ________ the Football Club and
the Karate Club. I 3) _______ those clubs because I love sports, especially football and karate.
I 4) ________ football on Sunday mornings and karate on Mondays at 4 p.m.
One
day my football club joined a football competition. There were eight clubs
joining the competition. At first, our club 5) __________ the match. Then, we
had to defeat one club to get to the final. Remarkably, we won again. After
those two matches, we 6) _________ lunch in the cafeteria nearby. We were so
impatient to play in the last game. It was the hard one because our opponent
was very tough. Finally, we won the game with a nice score of 3 – 2. We were
very happy and proud.
Activity 6. Ask your classmate is sitting next to
you and say what you did last weekend.
Look at the following example.
For
example:
1. You : What did you do on your
last weekend?
Your
friend : It was alright. I didn't
do anything special.
2. You : Did you have a good
weekend?
Your
friend : Yes. It was great. I had
a lovely time. I went to theatre and I watched a
great movie.
Activity 7. Study
and pronounce the following words. Then, read the text on Torajan funeral and
answer the questions.
balcony (kb) : balkon
coffin (kb) : peti
mati
corpse (kb) : jenazah
elaborate (ks) : rumit
kin (kb) : sanak;
famili
slaughter (kkt) : menyembelih
My
Grandpa’s Funeral in Toraja
Last month my family and I went to Toraja to attend Grandpa’s funeral. It was my first time to
go to such a ceremony. We gathered there with our kind in the ceremony.
Overall, the
ceremony was quite elaborate. It took about a week. Several days before the
ceremony was done, grandpa’s body was kept in a series of houses arranged in
circular row around an open field called tongkonan. His corpse was dressed in a fine wearing.
The funeral was performed in two phases. First, we slaughtered
the pigs and buffaloes, and then moved the corpse to face north. In this
ceremony we wore black clothes. After that, the corpse was placed in a sandal
wood coffin. Then, it was brought out of the house and placed on an open
platform beneath the granary. Meanwhile, my uncle, my brother, and I prepared
the wooden puppet and a funeral tower called lakian.
The next phase of the ceremony was held in this place. The coffin is borne from
the house and placed in the lakian. During the day, there were also
buffalo matches. They were great matches. In the night, we were feasting,
chanting, and dancing.
On the last day, the grandpa’s coffin were lowered from
the funeral tower and brought up to the mountainside family graveyard. Great
shouting and excitement followed it from the relatives and the guests. Finally,
we installed the wooden puppet on a high balcony where other puppets
representing the members of a whole family were already there.
The funeral ceremonies made my family and me tired. However,
we were grateful because it ran smoothly.
Questions:
1. When did the writer attend the
funeral?
2. How long did the writer and his
family hold the ceremony?
3. What did they do to the corpse
before the funeral was done?
4. What did they do after the corpse
was placed in a sandal wood coffin?
5. What did they do on the last day
of the ceremony?
Notes:
In a recount
text, you find words and phrases used to start, connect a sentence with the
next one, and
end your composition. Those words and phrases are: First, Then,
After that, Final.
Let’s Make a
Summary
A recount text is a text that tells
about a part of experience. A recount text has an orientation, a series of
events in chronological order, personal remarks on the events, and a
re-orientation that “rounds off” the sequence of events. In the text, you will
find words and phrases used to start, connect a sentence with the next one, and
end your composition.
 2.
2.
 NARRATIVE
NARRATIVE
Social function : to amuse, entertain and to
deal with actual or vicarious experience
in
different ways.
Generic Structure :
·
Orientation
:
sets the scene and introduces the participants (intro-
duces the main
characters in a setting of time
and place).
·
Complication: a crisis/ problems arises.
·
Resolution : the crisis is resolved, for better or for
worse.
Language Features : - use of noun phrases ( a beautiful princess,
huge temple)
use of Simple Past Tenses ( He walked away from the village)
- use of nouns and pronouns to identify people or things involved;
- use of conjunction and time connectives to sequence the events;
- use of adverbs and adverbial phrases to
indicate place and time;
- use of adjectives to describe nouns.
Activity 1.
Answer these following questions.
1. Have you ever written a story?
2. What do you do first when you write a
story?
3. Have you ever written a
fairy tale?
4.
Are there any differences between writing fairy tales and ordinary short stories?
Activity 2.Read
and study
the text structure of the narrative text.
The Fortune Teller
In
the great city of Taipei, there lived a man called Lin and his wife. They had
no children. Because of this, they were very unhappy. One day, they found a
baby boy outside their door. He was wrapped in a blanket and crying. They took
the baby into their house and called him Sau Ling. They loved him very much.
When
Sau Ling was a young man, a fortune-teller came to the house. "You must
send your son away," he said. "One day he will become a thief and
cause you a lot of trouble."
Mr and Mrs Lin were very sad to hear this.
They believed what the fortune-teller said. They gave Sau Ling some clothes and
money and sent him away.
Several
years later, Sau Ling was having a meal in an inn several miles from Taipei. He
put his bag on the floor near his table. After finishing his meal, he picked up
his bag. "That's strange!" he thought, "It feels so
heavy."He looked inside. It was full of small gold bars. Then he realized
that someone had taken his bag by mistake and left another bag, in its place.
That
evening, a young man came to the inn, "Has anyone seen my bag?" he
asked. Sau Ling was very honest. He returned the bag to him. The young man
thanked him. "You are really very honest," he said, "I shall ask
may to say. He left the house without saying a word. Mr and Mrs Lin never
believed in fortune-teller after that. Sau Ling took them to live with him and
they were very happy and contented until the end of their lives.
Taken
from Favorite
Stories from Taiwan,
2000
Activity 3.
Punctuate and capitalize the following
story.
one day a monkey wanted to cross a river he saw a crocodile in the
river so he asked the crocodile told the monkey to jump onto its back then the
crocodile swam down the river
now the crocodile was very hungry so when it was in the middle of
the river it stopped and said to the monkey monkey my father is very sick he
must eat the heart of a monkey the he will be strong again
the monkey thought for a while then he told the crocodile to swim
back to the river bankwhat for asked the crocodile because i didn't bring my heart with
me said the monkey I left it under the tree near some coconuts
so the crocodile turned around and swam back
to the bank of the river as soon as they reached the river bank the monkey
jumped off the crocodiles back and climbed up to the top of a tree
where is your heart asked the crocodile
you are foolish the monkey said to the
crocodile now i am free and you have nothing
the monkey told the crocodile not to try to
trick him again the crocodile swam away hungry
Taken from www.aesopfables.com
Activity 4.Answer the following questions
based on the text in Activity3Setting nts Outcome 1. How many characters are there
in the story? Mention them.
2. Where
did the story probably take place?
3. What the
monkey wanted in the river?
4. What
the crocodile said when it was in the middle of
the river?
5. Did the
crocodile succeed
in getting heart of a monkey?
6. What do
you call a story that talks about animals which can speak?
7. What is the message of the story?
Activity 5. Read another narrative story .
The Fox and the Crow
A crow, perched in a tree with a piece of cheese in his beak, attracted
the eye and nose of a fox. "If you can sing as prettily as you sit,"
said the fox, "then you are the prettiest singer within my scent and
sight." The fox had read somewhere, and somewhere, and somewhere else,
that praising the voice of a crow with a cheese in his beak would make him drop
the cheese and sing. But this is not what happened to this particular crow in
this particular case.
"They say you are sly and they say you are crazy," said
the crow, having
carefully removed the
cheese from his beak with the claws of one foot, "but you must be
nearsighted as well. Warblers wear gay hats and colored jackets and bright
vest, and they are a dollar a hundred. I wear black and I am unique."
I am sure you
are," said the fox, who was
neither crazy nor nearsighted, but sly.
"I recognize you, now that I look more closely, as the most famed and
talented of all birds, and I fain would hear you tell about yourself, but I am
hungry and must go." "Tarry awhile," said the crow quickly,
"and share my lunch with me." Whereupon he tossed the cunning fox the
lion's share of the cheese, and began to tell about himself. "A ship that
sails without a crow's nest sails to doom," he said. "Bars may come and
bars may go, but crow bars last forever. I am the pioneer of flight, I am the
map maker. Last, but never least, my flight is known to scientists and engineers,
geometricians, and scholar, as the shortest distance between two points. Any
two points," he concluded arrogantly. "Oh, every two points, I am sure,"
said the fox. "And thank you for the lion's share of what I know you could
not spare." And with this he trotted away into the woods, his appetite appeased,
leaving the hungry crow perched forlornly in the tree.
Taken from www.aesopfables.com
Activity 6.Answer the following
questions based on the text in Activity5
1. How many characters
are there in the story?
2. Where did the story probably take
place?
3. Why did the fox praise the voice of
the crow?
4. Had the crow known the fox's plan
of praising him?
5. Did the fox give up trying to
persuade the crow to share his lunch?
6. What did the fox do in order that
the crow shared his lunch?
7. Did the fox succeed in getting what
he wanted?
8. What is the moral of
the story?
Let’s
Make a Summary
Every text has its own structure. The
structure of narrative text consists of three parts: complication, and
resolution. Orientation describes scene and introduces the participants of the
story. Complication begins when there is a problem in resolution. The structure
of narrative text occurs in the text variously. A text may have only one
complication and resolution but another text may have more than complication
and resolution.
3.
 PROCEDURE
PROCEDURE
Social function: to
describe how something is accomplished through a sequence
of actions or steps.
Generic Structure :
·
Goal ( the
final purpose of doing the instruction)
·
Materials
(not required for all procedural texts)
·
Steps (a
series of steps oriented to achieving the goal)
Language Features : - the use
of commands ( cut, add, pour, don’t mix
)
the use of action verbs ( wash, boil,
turn, put )
the
use of connectives ( first, then, finally,…. )
the use of adverbials phrases ( for five
minutes, two centimeters from the top ).
Activity 1.Read and study the text structure of the procedure
text.
The
Hole Game
Two player, one marble per person, a hole in
ground, and a line (distance) to
start from.
First you must dub (click marble together).
Then you must check that the marble are in good condition and are nearly
worth the same value.
Next you must dig a hole in the ground and
draw a line a fair distance away from
the hole. first player carefully throws his or her marble towards the hole. Then the second player tries to throw
his or her marble closer to the hole than his or her opponent. The
player whose marble is closest to the hole tries to flick his or her marble into the hole. If
necessary this player to flick his or her opponent’s marble into the hole. The person
flicking the last marble into the hole wins and gets to keep both marble.
Activity 2.Answer the following
questions based on the text in Activity 1
1.What
does the text tell us about ?
2.How
many players are involved in the game?
3.What
important thing is used in the game?
4.how
many steps are there in the instruction?
5.How
can a player win the game?
Activity 3. Now
read another text and identify the structure of the text.
Bregedel
Tempe (Tempe Fritters)
• 150 g tempe
• 2 tablespoons fried
shallots
• 3 kaffir lime leaves
• 1 tablespoon flour
• 1 egg
• 1 cup vegetable
oil for frying Spice paste:
• 3 large chilies,
seeds removed
• 3 small chilies
• 2 red shallots
• 2 cloves garlic
• 1/2 teaspoon chopped galangal
• 1 candle nut
• 1/2 teaspoon coriander seeds
• 1/2 teaspoon salt
• 1/4 teaspoon shrimp paste
1. Mash the tempe with
a fork or place in the bowl of a food processor and blend until it resembles coarse bread crumbs.
2. Grind the spices in
a mortar and pestle or place in the bowl of a food processor and blend to a
smooth paste.
3. Put the mashed
tempe in a bowl and mix with the spice paste, fried shallots and lime leaves.
Stir in the flour, followed by the egg.
4. Shape the tempe
into fritters the size of a golf ball and flatten a little with a fork.
5. Heat the vegetable
oil in a wok over a medium flame.
When the oil is hot,
drop the fritters into the oil, five or six at a time.
6. Fry until golden
brown on both sides, drain on absorbent paper and serve hot with rice.
Taken from The Jakarta Post, May 2, 2004
Activity 4. Pronounce the following words and find their
meaning.
Pay attention to
your pronunciation.
1. instruction
2. procedure
3. recipe
4. ingredients
5. knead
6. roll out
7. sprinkle
8. press
9. grease
10. knuckle
11. mix
12. blend
13. oven
14. fold
15. margarine
Activity 5.Say
it Right
absorbent /əb’zɔ:bənt/ (ks) : menyerap
cheese /t∫i:z/
(kb) : keju
drain /dreɪn/ (kkt) : meniriskan
flour /’flaʊə/ (kb) : tepung
fry /fraɪ/ (kkt) : menggoreng
mash /maə∫/ (kkt) : melenyehkan
mix /mɪks/ (kkt) : mencampur
recipe /’resɪpɪ/ (kb) : resep
Sumber ; http://aderikardo.blogspot.com
 = jumlah partikel
= jumlah partikel